为了更好的体验,请使用竖屏浏览
PIK3CA写入最新乳腺癌2019 NCCN V.2指南
发布日期:2021-11-30 浏览次数:2800
PIK3CA写入最新乳腺癌2019 NCCN V.2指南
导读:5月24日FDA刚刚批准了诺华公司(Novartis)针对PIK3CA基因突变的特异性PI3K抑制剂Piqray(Alpelisib,BYL719)上市,随后NCCN于7月2日发布的乳腺癌指南2019年第2版(2019 V2版)中便将PIK3CA基因突变检测及PI3K抑制剂Alpelisib写入了指南,关于指南更新情况详见正文。
2019年5月24日,FDA批准了诺华公司(Novartis)的PI3K抑制剂Piqray(Alpelisib,BYL719)上市,用于与内分泌疗法氟维司群联用,治疗接受过内分泌疗法后疾病进展、携带PIK3CA基因突变、HR+/HER2-晚期或转移性绝经后妇女和男性乳腺癌患者。值得关注的是,这是全球首款获批上市作用于实体肿瘤的PI3K抑制剂!

▲ 2019年7月2日 乳腺癌NCCN V2.2019指南更新
01 乳腺癌 NCCN V2.2019 指南重要更新
● HR阳性/HER2阴性的乳腺癌患者如果考虑使用Alpelisib,可以进行组织或血液的PIK3CA基因检测;● PIK3CA基因突变检测样本类型可以是肿瘤组织,也可以是外周血ctDNA(液体活检)。如果ctDNA(液体活检)检测结果是阴性,建议再用肿瘤组织进行检测。● 对PIK3CA基因突变且HER2阴性的绝经后乳腺癌患者,首选 Fulvestrant(氟维司群)+ Alpelisib 联合治疗方案(1类证据)。

▲ 重要更新:PIK3CA基因突变检测及Alpelisib联合治疗方案

▲ 如果考虑使用Alpelisib,可进行组织或血液的PIK3CA基因检测
02 乳腺癌 NCCN V2.2019重要更新依据
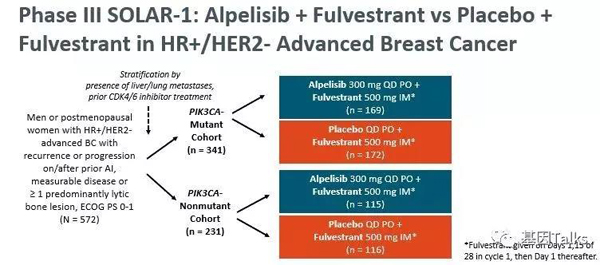
▲ SOLAR-1的研究方案

▲ PIK3CA突变组:mPFS 11.0个月 vs 5.7个月

▲ PIK3CA未突变组:mPFS 7.4个月 vs 5.6个月,无显著差异
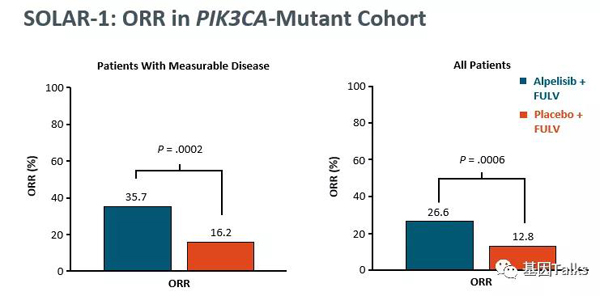
▲ PIK3CA突变组:对比两组的ORR,可见Alpelisib+氟维司群的ORR显著更优。在可测量病灶的患者中,两组ORR分别为35.7% vs 16.2%;在所有患者中,ORR分别为26.6% vs 12.8%。
03 PIK3CA基因突变发生率

▲ PIK3CA突变占HR+/HER2-乳腺癌患者40%左右
04 PIK3CA基因突变检测方法
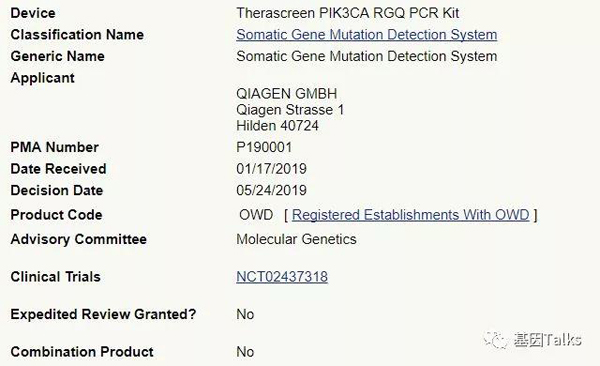
▲ PIK3CA伴随诊断试剂盒信息
● 外显子7:C420R;● 外显子9:E542K,E545A,E545D (1635G>T),E545G,E545K,Q546E,Q546R;● 外显子20:H1047L,H1047R,H1047Y。
*标红为主要突变类型

▲ 组织中PIK3CA常见突变类型

▲ 血液cfDNA中PIK3CA常见突变类型

 网站首页
网站首页 一键拨打
一键拨打 联系我们
联系我们